Sự chết tế bào có thể đảo ngược
Năm 2007, Ho Man “Holly” Tang đã tạm dừng các nghiên cứu trước tốt nghiệp tại Đại học bang Iowa để tham gia cùng anh trai mình, Ho Lam “Hogan” Tang, nghiên cứu sinh tiến sĩ tại Đại học Trung văn Hương Cảng – Chinese University of Hong Kong (CUHK), để làm việc chung trong một dự án. Trong phòng thí nghiệm miễn dịch Ming-Chiu Fung, Hogan đã nghiên cứu làm thế nào các rối loạn trong tế bào tế bào có thể góp phần vào sự phá hủy ty thể trong quá trình apoptosis, hình thức “tự tử” phổ biến nhất của tế bào. Nhưng hai anh em khi ấy có một câu hỏi cơ bản hơn: Các tế bào có thể phục hồi lại từ đống hỗn động của tế bào sau khi apoptosis được kích hoạt hay không?
Có nhiều yếu tố khác nhau có thể khởi phát apoptosis, nhưng rốt cuộc tất cả chúng đều kích hoạt những ‘kẻ thực thi’ được gọi là caspase. Cắt hàng trăm loại protein khác nhau trong tế bào, các enzyme này tàn phá bộ gen, tấn công các protein cấu trúc cấu tạo các bào quan tế bào, và phá hủy tế bào, dẫn đến việc tế bào co lại, rò rỉ, phân mảnh và dường như đã chết. “Vào thời điểm đó, và ngay cả bây giờ, giáo điều chung mà người ta thừa nhận là apoptosis là không thể đảo ngược,” Hogan (sau đây gọi tên là Tang) nhắc lại. “Holly và tôi rất tò mò và hỏi: ‘Điều này có thực sự đúng không?’”
Anh em Tang đã cho nhiều loại tế bào ung thư của người tiếp xúc với các độc tố như ethanol và chờ đợi các dấu hiệu apoptosis xuất hiện ổn định, như kích hoạt caspase và co tế bào. Tiếp theo, thay vì vứt bỏ các tế bào “chết” đi, “chúng tôi đã rửa và ủ chúng với môi trường mới qua đêm,” Tang nói.
“Đáng ngạc nhiên là một số tế bào đã có lại được hình thái bình thường khi chúng tôi quan sát chúng vào sáng hôm sau.” Hai anh em đặt tên cho hiện tượng này là Anastasis. Apoptosis có nghĩa là “sự rơi rụng” theo tiếng Hy Lạp, và quá trình này tạo điều kiện thuận lợi cho sự ra đi tự nhiên của các tế bào, giống như những cánh hoa rơi xuống từ một bông hoa phai màu hoặc lá từ một cây vào mùa thu. Trái lại, Anastasis có nghĩa là “sự trỗi dậy”, và trong Kitô giáo nó hàm ý sự phục sinh của Chúa Giêsu.
Cộng đồng nghiên cứu ban đầu hoài nghi về việc các tế bào có thể trở về từ cõi chết. “Phát hiện của chúng tôi khá gây tranh cãi – một trong số vài bài báo đầu tiên của chúng tôi đã bị từ chối hơn 11 lần trong ba năm,” Tang, hiện là nhà sinh học phân tử và di truyền tại Đại học Johns Hopkins, cho biết.
Anh đã thực hiện nhiều thí nghiệm củng cố thêm cho anastasis sau khi anh tham gia phòng thí nghiệm của Denise Montell, một nhà sinh vật học tế bào và phát triển tại Johns Hopkins. Phối hợp với phòng thí nghiệm mới cùng các đồng nghiệp cũ ở Trung Quốc và em gái, người đã theo anh ấy đến Baltimore sau khi nhận bằng thạc sĩ tại bang Iowa, Tang đã tiến hành các thí nghiệm không chỉ trên các dòng tế bào ung thư ở người, như HeLa, mà còn trên các tế bào bình thường, như tế bào gan chuột, tim chuột và tế bào não chồn nuôi cấy, cũng như nhiều tế bào người nuôi cấy, bao gồm cả nguyên bào sợi [1]. Thời gian trôi đi và một lần nữa, các tế bào dường như đã phục hồi sau khi quá trình apoptosis đã đi đến giai đoạn cuối, ngay cả sau khi bị tổn thương DNA và phân mảnh tế bào. “Khoảnh khắc tôi thực sự biết có một hiện tượng quan trọng là khi chúng tôi làm một thước phim về toàn bộ các tế bào ung thư phổi của con người co lại, rò rỉ và sau đó hồi phục,” Montell, đang làm việc tại Đại học California, Santa Barbara phấn khích miêu tả.
Kể từ năm 2012, khi anastasis được đặt tên chính thức, các nhà nghiên cứu đã nghiên cứu sâu hơn về cách chính xác các tế bào (dường như) có thể tự gắn lại với nhau sau khi bị hư hỏng nặng do apoptosis. Các nhà khoa học đã chứng kiến ty thể bị phân mảnh trong các tế bào người được nuôi cấy trở lại nghiên vẹn, và các mRNA được tạo ra và dự trữ trong quá trình apoptosis để giúp các tế bào bắt đầu sống lại. Họ cũng đã tìm thấy bằng chứng cho thấy anastasis có thể xảy ra in vivo ở ruồi giấm.
Stephen Tait, một nhà sinh học tế bào tại Đại học Glasgow cho biết, “chúng tôi luôn xem apoptosis như là một quá trình dứt khoát, tất cả hoặc không gì cả, vì thế thật thú vị khi nghiên cứu bắt đầu tìm ra những điểm mới. Bạn có thể kích hoạt caspase để cắt tất cả các protein này theo cách dường như không thể phục hồi được nữa, nhưng tế bào vẫn tồn tại bằng cách nào đó.”
Tiết lộ mới có thể thay đổi cách mà các nhà khoa học định nghĩa sự sống và cái chết ở cấp độ tế bào, Yinan Gong, một nhà miễn dịch học và nhà sinh học tế bào tại Trung tâm Y tế Đại học Pittsburgh cho biết thêm. “Cái chết có ý nghĩa gì với một tế bào?”
Tế bào sống sót như thế nào?
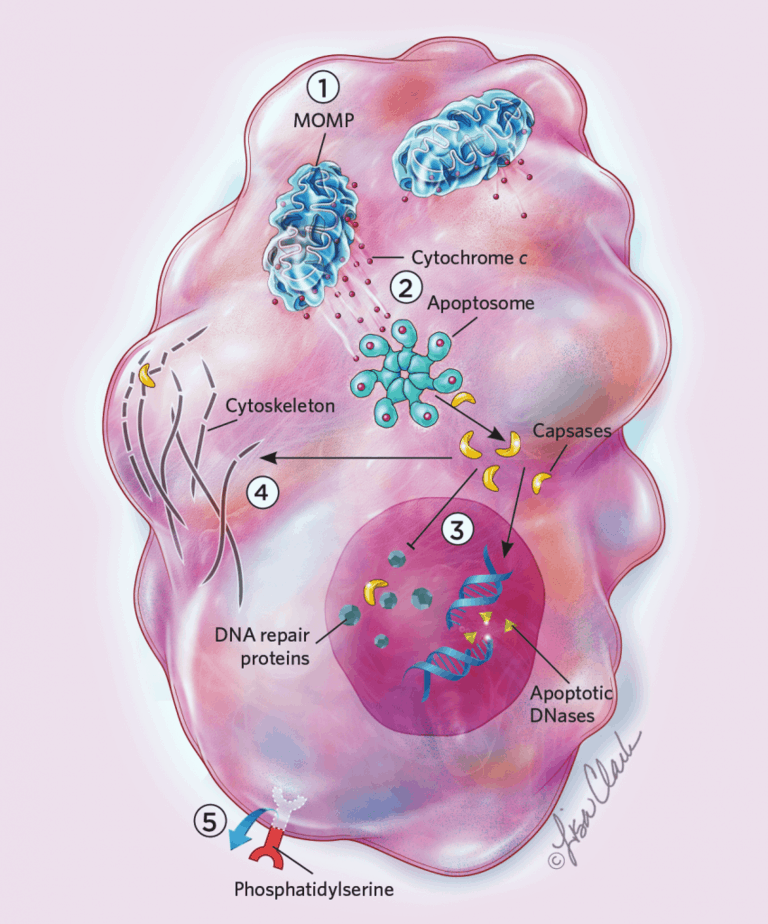
Tế bào có thể sống được trong vài ngày, vài tháng, thậm chí hàng năm, nhưng ngay khi apoptosis đã bắt đầu, sẽ chẳng mất bao lâu để mọi thứ được sắp đặt cho một cái chết. Trong vòng 10 phút hoạt hóa caspase, hình thái tế bào lập tức chuyển biến: màng tế bào trở nên méo mó do tế bào co lại, và DNA cô đặc thành các bó rồi sau đó bị cắt vụn. Caspases cũng khiến phosphatidylserine lật từ màng trong ra màng ngoài của tế bào, tạo ra một tín hiệu “hãy nuốt tôi đi” báo cho các đại thực bào biết. “Tế bào kích hoạt các caspase y như những sát thủ giết thuê, chúng cắt có lẽ phải hàng trăm cơ chất trong tế bào và làm tế bào “sụp đổ” chỉ trong thời gian 5 đến 10 phút,” Gabriel Ichim, nhà sinh học tế bào tại Đại học Lyon (Pháp) mô tả.
© LISA CLARK
Apoptosis có thể được bật theo nhiều cách khác nhau, nhưng chúng rốt cuộc đều kích hoạt các enzyme gọi là caspases làm phá hủy DNA, các bào quan và bộ khung xương tế bào. Caspases cũng là tác nhân kêu gọi các tế bào khác đến và ăn những phần còn lại của một tế bào đang chết. Kể cả sau khi bắt đầu quá trình tự kết liễu này, các tế bào vẫn có thể phục hồi thông qua một quá trình mới được phát hiện gần đây được gọi là anastasis. Nhưng nếu anastasis diễn ra sau apoptosis, các tế bào tồn tại được có thể mang những “vết sẹo” lớn trên nhiễm sắc thể và các khiếm khuyết di truyền khác thậm chí có thể là mầm mống ung thư.
Vào năm 2015, khi nghiên cứu các tế bào người in vivo, Ichim, Tait và các cộng sự đã mô tả một hiện tượng tương tự (chứ không phải) anastasis được gọi là “apoptosis lỗi”, trong đó các tế bào phục hồi sau khi mới trải qua một phần những diễn biến thường xảy ra trong apoptosis [2]. Trước đó người ta nghĩ rằng khi ty thể của tế bào bắt đầu rò rỉ cytochrome c, một chất khởi động caspases, tất cả các bào quan sẽ chịu ảnh hưởng một cách đồng bộ khắp tế bào. Tuy nhiên khi các nhà khoa học kiểm tra, họ phát hiện ra rằng đôi khi chỉ một số ít ty thể phát tán cytochrome c, tức là chỉ một tỉ lệ nhỏ caspases được hoạt hóa, và tế bào vẫn sống sót [3].
Giống như anastasis, apoptosis lỗi cho thấy sự khởi đầu apoptosis không đồng nghĩa với cái chết được phán quyết như người ta vẫn nghĩ, Tait cho biết. Nhưng apoptosis lỗi liên quan đến các tế bào chỉ trải qua một phần của apoptosis – các mức độ hoạt hóa caspases thấp hơn nhiều so với khi apoptosis thành công, và chỉ một số lượng hữu hạn các đích chủ chốt của enzyme là bị phá hủy. Ngược lại, các phát hiện của Tang gợi ý rằng các tế bào thậm chí còn còn thể phục hồi khi apoptosis đã hoàn toàn quét qua, Tait nhận xét.
Anh em nhà Tang và các cộng sự đã phát hiện chẳng hạn anastasis có thể cho phép đảo ngược apoptosis kể cả sau khi tế bào đã bắt đầu vỡ vụn. Đầu năm nay (2019), các nhà nghiên cứu đã công bố những hình ảnh hiển vi time-lapse tế bào sống cho thấy các mảnh tế bào HeLa tái lắp ráp thành một tế bào nhìn có vẻ có hình thái bình thường [3]. Có vẻ chưa cần quan tâm apoptosis bắt đầu như thế nào; nếu các điều kiện là thuận lợi cho việc phục sinh, anastasis có thể giải cứu tế bào khỏi nhiều thương tổn, như là shock lạnh, thiếu thốn protein và tiếp xúc với hóa chất độc hại. Trong các tế bào đã tiến đến các giai đoạn cuối của apoptosis, các ty thể đã phân mảnh thậm chí còn có thể dung hợp với nhau và có lại được các cấu trúc bình thường, anh em Tang và cộng sự đã phát hiện như vậy [3,4]. Việc khôi phục các tế bào cũng làm mất đi tín hiệu “nuốt tôi đi” trên bề mặt tế bào sau chỉ vài giờ, nhờ thế thoát khỏi sự thực bào [1].
Năm 2017, Montell và anh em Tangs đã độc lập công bố những nghiên cứu đào sâu hơn vào các dấu hiệu của anastasis. Nhóm của Montell đã phát hiện ra rằng hơn 1000 gen được điều hòa biểu hiện mạnh hơn trong các tế bào HeLa đang trải qua apoptosis trong môi trường nuôi mới, và rằng các phản ứng cấp độ phân tử của anastasis là tương tự ở mức độ nhất định so với các đáp ứng trong các tế bào đang phục hồi từ quá trình tự thực, một quá trình trong đó các protein và bào quan tế bào được tái chế [5]. Ngoài ra, mRNAs có liên quan đến sự giải cứu tế bào có vẻ được tích tụ trước khi apoptosis bị ngừng lại, gợi ý rằng các tế bào có sự chuẩn bị cho anastasis vào thời kỳ đầu của apoptosis, như một hình thức phục hồi tiềm năng. Trong suốt anastasis ở các tế bào gan chuột, Tang và cộng sự đã lưu ý thấy những thay đổi to lớn trong sự biểu hiện các gen liên quan đến việc loại bỏ ty thể đã hư hỏng, các gốc tự do có hại và các thành phần của bào quan, cũng như việc trì hoãn chu kỳ tế bào, có lẽ để cho tế bào thời gian để sửa chữa [6].
Thông điệp mà chúng ta có được rất rõ ràng, Tait cho biết: cái chết của tế bào là không rõ ràng. “Có quan điểm rằng tế bào chết hoặc không, nhưng tôi nghĩ một cách chắc chẵn rằng phải có nhiều khoảng tối giữa sống và chết”.
Sự công nhận anastasis
Một lý do khiến anastasis – sự phục sinh tế bào vẫn còn là tranh cãi là câu hỏi liệu có hay không các tế bào được ghi nhận còn sống sau khi tiếp xúc với các stress gây apoptosis đã thực sự trải qua quá trình hoạt hóa caspase, hoặc liệu có phải chúng đã tránh các áp lực có thể dẫn tới sự kích hoạt những kẻ thực thi? Các tế bào đã trải qua anastasis không thể nào phân biệt được với các tế bào khỏe mạnh bên cạnh. “Thực sự là thách thức khi theo dõi các tế bào đang sống trong một thời gian dài, nhất là in vivo,” Ichim nói.
Để giám sát sự tồn tại của tế bào in vivo sau khi apoptosis đã khởi động, anh em Tang và Montell đã độc lập phát triển các cấu trúc gen – tương ứng là CaspaseTracker7 vào năm 2015 và CasExpress8 năm 2016 – tạo ra các protein huỳnh quang trong quá trình hoạt hóa caspase, và sau đó phát quang ra một màu khác. Họ sau đó theo dõi số phận các tế bào bằng kính hiển vi.
Phương pháp này đã lần đầu tiên giúp các nhóm quan sát anastasis trong ống nghiệm. Sử dụng các cấu trúc này, hai nhóm đã thấy các tế bào ở nhiều loại mô khác nhau trong phôi ruồi giấm trải qua sự hoạt hóa caspase và trải qua toàn bộ các dấu hiệu thông thường của apoptosis – như tế bào co lại và màng thủng lỗ chỗ – trước khi phục hồi hoàn toàn. Các nhà nghiên cứu đang cố tìm kiếm hiện tượng này trên động vật gặm nhấm.

© LISA CLARK
Các kết quả vẫn chưa được chấp nhận rộng rãi, một phần vì nghiên cứu trước đó đã chỉ ra rằng caspases đóng góp vào các quá trình không riêng gì apoptosis. Ví dụ, trong hệ thống thần kinh, caspases được kích hoạt trong quá trình giản lược exon liên quan đến học tập và trí nhớ, theo Scott Dixon, nhà hóa sinh học tại Đại học Stanford, vì thế sự hoạt hóa caspase có thể không phải một dấu chuẩn chắc chắn của apoptosis.
Montell và các cộng sự của cô chú ý rằng có một cách phân biệt hoạt động của anastasis với các quá trình khác có liên quan đến caspases là sự hoạt hóa caspase không liên quan đến apoptosis thường diễn ra ở các giai đoạn nhất định và ở mọi tế bào của cùng một loại mô. Ngược lại, trong quá trình phát triển, anastasis có thể diễn ra ngẫu nhiên trong một nhóm tế bào rải rác qua thời gian [9]. Montell đồng ý rằng cần nhiều nghiên cứu hơn để hiểu được chính xác điều gì diễn ra. Giả định rằng các tế bào có thể dưới một số tình huống phục hồi trở lại từ apoptosis (cũng như các quá trình có vẻ gây chết khác), vẫn không rõ ràng rằng sự phục hồi này chung chung hay quan trọng như thế nào.
Vai trò của việc đảo ngược apoptosis
Một trong những vai trò của anastasis là nó như một cơ chế sinh tồn của tế bào, hạn chế tổn thương vĩnh viễn có thể xảy ra để đáp ứng với những tình huống tạm thời. Ví dụ, các mô trong một cơ thể đang phát triển có thể ngẫu nhiên gặp phải tình trạng thiếu hụt các yếu tố tăng trưởng, một sự kiện có thể kích hoạt quá trình apoptosis tại thời điểm các tế bào đang tăng sinh với tốc độ nhanh. Montell và các đồng nghiệp của cô đã phát hiện ra rằng anastasis có thể xảy ra trong quá trình phát triển ở ruồi giấm, với các tế bào sống sót sau khi kích hoạt caspase trong não của ấu trùng, trong quá trình biến thái, phát triển thành các chi và cơ quan trưởng thành [9].
Anastasis có thể cũng thúc đẩy thay đổi có tính tiến hóa, Tang nói. “Các nghiên cứu gần đây của chúng tôi đã chứng minh sự xuất hiện của anastsis trong các tế bào mầm của ruồi giấm sau khi tiếp xúc trong thời gian ngắn với các stress sinh lý và môi trường như thiếu thức ăn hoặc sốc lạnh, ông nhấn mạnh [8]. Điều này gợi nên khả năng rằng các tế bào này có thể đã có được những đổi biến mới xuất hiện trong apoptosis có thể được truyền lại cho con cháu.
Anastasis có thể phục vụ nhiều mục đích hơn là việc bảo vệ đơn thuần. Vào năm 2012, anh em nhà Tang và Montell đã phát hiện ra rằng trong khi các tế bào được giải cứu khỏi apoptosis có thể sửa chữa các tổn thương di truyền, đôi khi có những lỗi trong cách chúng hàn gắn genome của chúng. Kết quả là, một tỷ lệ tế bào sống sót có bất thường nhiễm sắc thể và các khiếm khuyết di truyền khác dẫn đến tăng trưởng ác tính. Điều này cho thấy rằng việc liên tục đưa các tế bào đến bờ vực của cái chết có thể giải thích nguy cơ ung thư cao hơn ở các mô tiếp xúc với các cuộc tấn công lặp đi lặp lại, như ung thư gan do nghiện rượu và ung thư miệng, thực quản hoặc ung thư dạ dày có thể do tiêu thụ thường xuyên đồ uống nóng [6]. Ngay cả trong trường hợp apoptosis lỗi, tức là tổn thương trước quá trình đảo ngược ít nghiêm trọng hơn, bộ gen của tế bào đôi khi không ổn định và một số tế bào thậm chí biến thành ác tính, theo nghiên cứu của Tait, Ichim và cộng sự [2]. “Chúng tôi đang theo dõi các tế bào để xem liệu có hậu quả lâu dài liên quan đến sự tiến triển của bệnh ung thư hay không và chúng tôi thấy các tế bào có thể gặp phải tình trạng mất ổn định hệ gen,” Ichim cho biết. “Chúng có thể ác tính hơn và tạo thành khối u lớn hơn ở chuột.”
Khả năng phục hồi tế bào từ cái chết được lập trình cũng có thể đóng một vai trò trong một số trường hợp bệnh ung thư trốn tránh liệu pháp điều trị. Xạ trị và nhiều loại thuốc hóa trị thường được sử dụng để gây apoptosis và trong hai liệu pháp này có thể giết chết hầu hết các tế bào khối u, bất kỳ tế bào ung thư nào còn sót lại cũng có thể dẫn đến tái phát và di căn [8]. Hơn nữa các tế bào ung thư sống sót qua các liệu pháp này có thể phát triển các đột biến mới giúp chúng kháng thuốc, theo lời Dedhar, người hiện đang tìm kiếm các tín hiệu phân tử được kích hoạt trong các tế bào ung thư đã sống lại từ bờ vực của cái chết.
Tang và các đồng nghiệp của anh cũng đã phát hiện ra rằng anastasis có thể kích hoạt các gen trong rồi giấm liên quan đến sự hình thành mạch và di chuyển tế bào [6], các quá trình có thể tăng cường hấp thụ chất dinh dưỡng và loại bỏ chất thải để giúp các tế bào thoát khỏi apoptosis, ông nói. Đồng thời, những thay đổi này có thể tăng cường sự lây lan của các tế bào ung thư.
Tang cho biết dựa vào mối liên hệ tiềm năng giữa ung thư và anastasis, các can thiệp nhắm vào quá trình này có thể giúp ngăn ngừa sự phát triển của ung thư hoặc điều trị một khi nó xuất hiện. Ức chế anastasis trong các tế bào ung thư đang chết trong và sau khi điều trị có thể là một chiến lược trị liệu mới để chữa ung thư bằng cách ức chế sự tái phát.
Ngược lại, ông lưu ý, nhắm vào anastasis một ngày nào đó có thể điều trị các bệnh mà căn nguyên từ việc mất đi các tế bào không thể tự làm mới, chẳng hạn như tế bào cơ tim hoặc tế bào thần kinh. “Hiện tại, một trong những nỗ lực chính trong phòng thí nghiệm của tôi tập trung vào việc xác định các tác nhân điều hòa anastasis then chốt và các phân tử thứ cấp thúc đẩy hoặc triệt tiêu anastasis,” Tang nói. “Phát hiện của chúng tôi sẽ cung cấp một danh sách các công cụ thiết yếu để kiểm soát quá trình phục sinh, từ đó đưa ra các lĩnh vực nghiên cứu mới để khám phá các chức năng và các ứng dụng điều trị tiềm năng của anastasis.
Cuối cùng, một vốn hiểu biết tốt hơn về anastasis có thể không chỉ giúp cứu các tế bào khỏi bệnh tật và tổn thương, mà còn chỉ cho các nhà khoa học nhiều hơn về cái chết của tế bào nói chung. “…liệu chúng ta có thể dự đoán số phận của các tế bào ở cấp độ đơn bào hay không” Gong nói. Ví dụ, nếu chúng ta chiếu xạ một khối u, chúng ta có thể biết rằng có thể 90 % khối u sẽ co lại, nhưng chúng ta đâu thể nói 90% đó là phần nào khối u. Dự đoán những tế bào nào sẽ chết và theo cách nào cuối cùng sẽ giúp chúng ta giảm thiểu tác dụng phụ và tối đa hóa các tác dụng có lợi. Đó là chết tế bào 2.0.”
Những mặt khác của cái chết
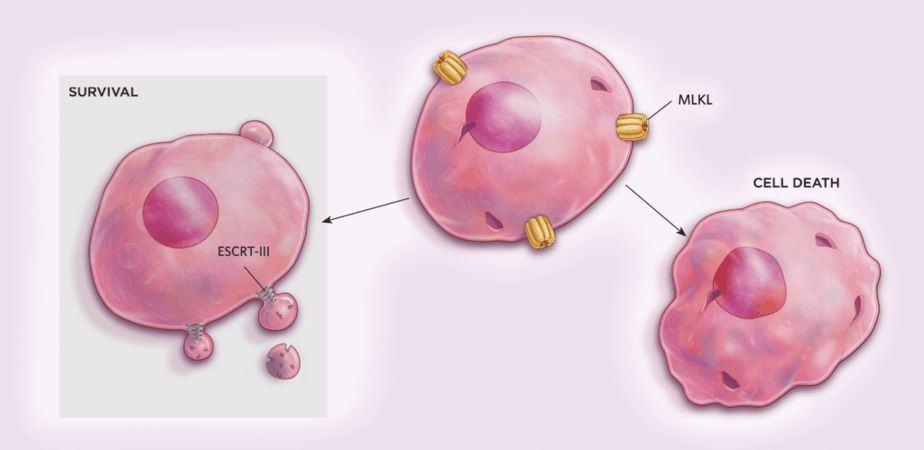
Anastasis không phải là cách duy nhất để cho các tế bào ở lại thực thi. Năm ngoái, trong các thí nghiệm liên quan đến việc làm bất hoạt gen trong các tế bào động vật có vú nuôi cấy, nhà miễn dịch học và nhà sinh học tế bào Yinan Gong thuộc Trung tâm Y tế Đại học Pittsburgh và các đồng nghiệp của ông đã bất ngờ phát hiện ra rằng một dạng chết tế bào được lập trình, necroptosis, cũng có thể đảo ngược.
Necroptosis là một phiên bản được lập trình của hoại tử, một dạng chết tế bào liên quan đến các phản ứng không kiểm soát được đối với tổn thương hoặc stress. Quá trình này bao gồm các lỗ chọc protein MLKL trên màng tế bào, khiến các tế bào bị vỡ. Tuy nhiên, tế bào có thể làm chậm quá trình này thông qua phức hợp protein ESCRT-III [9], nó cô lập các lỗ vào trong các bong bóng trên màng plasma. Loại bỏ những bong bóng cho phép sửa chữa các tế bào, một quá trình các nhà khoa học gọi là “sự hồi sức”.

© LISA CLARK
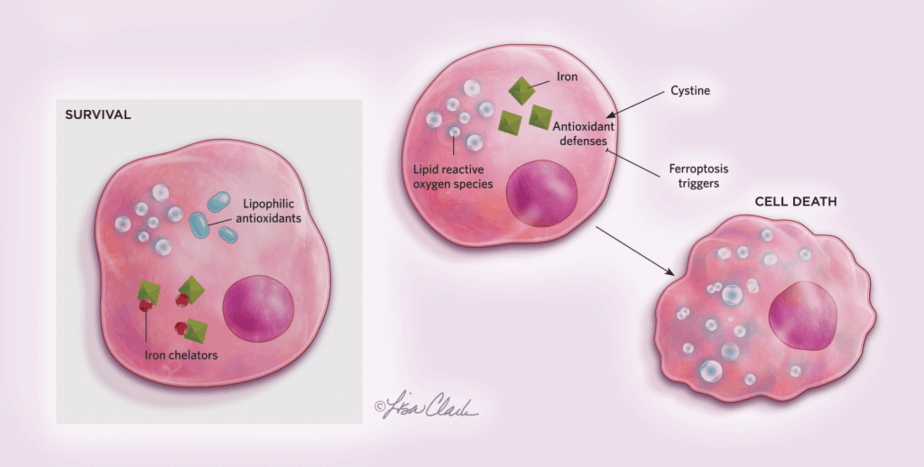
Các cách chết tế bào khác cũng có thể đảo ngược. Ví dụ, vào năm 2012, nhà hóa sinh học Scott Dixon từ Đại học Stanford đã phát hiện ra Ferroptosis, một dạng chết tế bào phụ thuộc vào sắt, có thể được đảo ngược bằng cách xử lý bằng chất chống oxy hóa lipophilic hoặc chất thải sắt. Các tế bào bắt đầu con đường này khi sự hấp thu và chuyển hóa bình thường của axit amin cysteine (cystine là dạng dimer oxy hóa của cysteine) bị xáo trộn. Sau khi được kích hoạt, ferroptosis sẽ dẫn đến chết tế bào trong vài giờ. Tuy nhiên, các nhà nghiên cứu có thể kiểm soát các chất chống oxy hóa lipophilic hoặc chất thải sắt để bảo vệ hoàn toàn các tế bào khỏi bị chết theo hình thức này.
© LISA CLARK
Ngay cả hình thức chết tế bào nổi bật được gọi là Entosis, trong đó một tế bào nuốt một tế bào khác, cũng có thể đảo ngược, cụ thể các tế bào bị nuốt có khả năng thoát để tiếp tục sống. “Khi một tế bào bị nuốt, nhân của nó có thể trông bình thường, màng của nó có thể trông ổn, và với video time-lapse, chúng tôi thấy nó có thể thoát ra và phân chia bình thường, Mike Overholtzer, một nhà sinh học tế bào tại Trung tâm ung thư Memorial Sloan Kettering ở New York cho biết. Ông và các đồng nghiệp của mình đã phát hiện ra rằng entosis phổ biến trong bệnh ung thư ở người và kích hoạt nó bao gồm tách ra khỏi chất nền ngoại bào và rút glucose [10], nhưng thứ gì quyết định số phận của tế bào bị thực bào vẫn chưa rõ ràng.
© LISA CLARK
Nói chung, những phát hiện này cho thấy những con đường này có thể không phải lúc nào cũng là ngõ cụt. Với chúng ta, khi một bác sĩ nhắc tới cái chết, thì bây giờ nó đã được định nghĩa rõ ràng – cái chết của não bộ. “Chúng ta biết rằng khi bệnh nhân đến một thời điểm nhất định, họ không thể quay lại,” Gong nói. “Câu hỏi vẫn còn bỏ ngỏ là đâu là điểm mà một tế bào phải chạm tới trước khi nó không quay trở lại nữa.”
Tham khảo
- H.L. Tang et al., “Cell survival, DNA damage, and oncogenic transformation after a transient and reversible apoptotic response,” Mol Biol Cell, 23:2240–52, 2012.
- G. Ichim et al., “Limited mitochondrial permeabilization causes DNA damage and genomic instability in the absence of cell death,” Mol Cell, 57:860–72, 2015.
- H.M. Tang et al., “Detecting anastasis in vivo by CaspaseTracker biosensor,” J Vis Exp, 132:e54107, 2018.
- H.M. Tang et al., “Molecular signature of anastasis for reversal of apoptosis,” F1000 Res, 6:43, 2017.
- G. Sun et al., “A molecular signature for anastasis, recovery from the brink of apoptotic cell death,” J Cell Biol, 216:3355–68, 2017.
- H.L. Tang et al., “In vivo CaspaseTracker biosensor system for detecting anastasis and non-apoptotic caspase activity,” Sci Rep, 5:9015, 2015.
- A.X. Ding et al., “CasExpress reveals widespread and diverse patterns of cell survival of caspase-3 activation during development in vivo,” eLife, 5:e10936, 2016.
- G. Sun, D.J. Montell, “Q&A: Cellular near-death experiences—what is anastasis?” BMC Biol, 15:92, 2017.
- Y.N. Gong et al., “ESCRT-III acts downstream of MLKL to regulate necroptotic cell death and its consequences,” Cell, 169:P286–300.e16, 2017.
- J.C. Hamann et al., “Entosis is induced by glucose starvation,” Cell Rep, 20:201–10, 2017.
iceberg/tapchisinhhoc.com